教員個人(研究室)ページ
生体機構学研究室
Laboratory of Functional Anatomy

<研究略歴>
2004年 明治大学農学部生命科学科卒業2006年 東京大学大学院医学系研究科医科学専攻修了
2010年 東京大学大学院医学系研究科病因・病理学専攻修了、博士(医学)、本庄国際奨学財団奨学生、日本学術振興会特別研究員(DC1)
UHA味覚糖株式会社、京都大学大学院医学研究科博士研究員、日本学術振興会特別研究員(PD)、国立研究開発法人医薬基盤・健康・栄養研究所主任研究員を経て、2022年より現職。専門は粘膜免疫学。
<主な担当科目>
生体機構学Ⅰ、生体機構学Ⅱ、生命科学実験IV(分担)、生命科学入門(分担)<ひとこと>
Meiji NOW「ようこそ研究室へ」に研究室の紹介記事が掲載されました(2025年1月)。https://meijinow.jp/study/seminar/109976研究テーマ
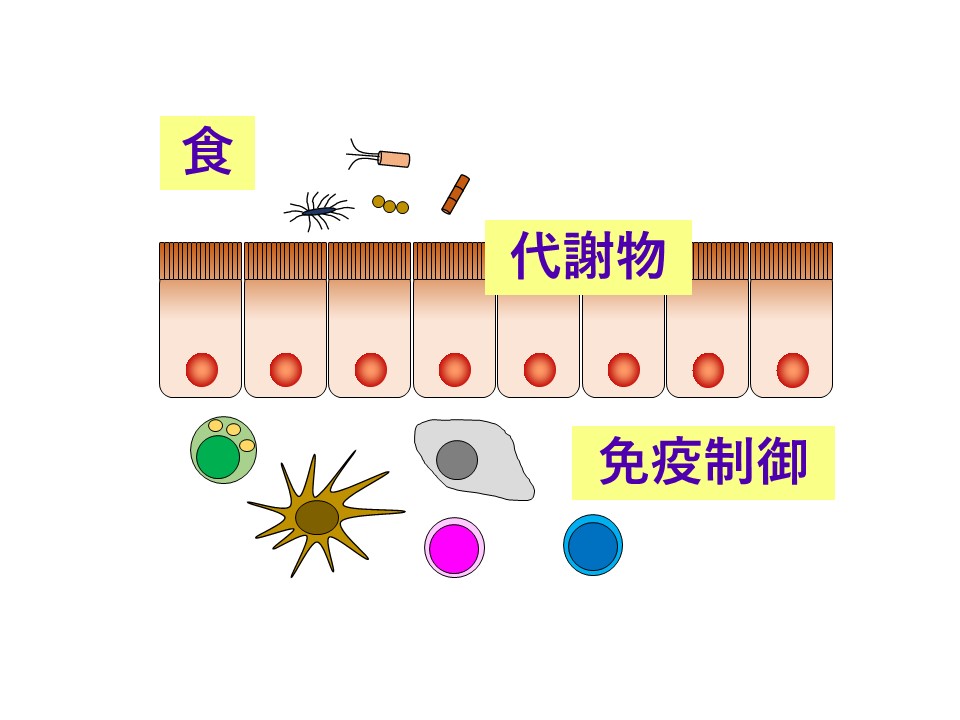
免疫システムはT細胞やB細胞、樹状細胞に代表される様々な免疫担当細胞が活躍し、サイトカインというコミュニケーションツールを使い、ダイナミックな連携プレーを遂行することで病原微生物を排除し、私たちの身体を感染症から防いでいます。しかしながら、この連携プレーが崩れると感染症が発症してしまうだけでなく、時にはサイトカインストームという免疫暴走状態に陥り重篤化することもあります。また本来応答すべきでない無害な抗原に異常に反応してしまうとアレルギー・炎症性疾患、自己免疫疾患の発症にも繋がります。すなわち、免疫は強ければ良いというものではなく、適切に制御されることが重要です。
免疫応答には個人差があることを皆さんも経験的に知っているのではないでしょうか。なぜ個人差が生じるのでしょうか?免疫システムは遺伝的背景だけでなく、様々な腸内環境因子によっても制御を受けていることが近年の研究で明らかになってきました。そうした腸内環境因子の一つに食事成分があります。特に、哺乳類の体内で合成できないオメガ3脂肪酸やオメガ6脂肪酸などの必須脂肪酸やビタミンについては、食の影響が強く出てきます。さらに、食事成分そのものが腸管免疫系に働く場合だけでなく、体内酵素や腸内細菌酵素により代謝されてできる代謝物に強力な免疫制御活性があることもわかってきています。そのため、遺伝的背景や腸内細菌叢の違いなどにより代謝酵素の発現パターンや活性レベルも異なり、同じ食事をしても代謝物の種類や産生量に個人差が生じ、得られる免疫効果が異なる可能性も考えられます。
こうしたこれまでの研究背景から、当研究室は「食」や「代謝物」が免疫応答やアレルギー・炎症の制御に働く可能性をさらに探求し、新規メカニズムを明らかにすることを目標に研究を行なっています。将来、個々に最適な栄養指導や医療を提供する個別化/層別化栄養・医療の実現を目指し、食事を介した免疫制御の可能性をマウスを用いて個体レベルで評価し、分子・細胞レベルでのメカニズム解明を行います。
研究室メンバー
2025年度は、大学院修士課程2年生3名、大学院修士課程1年生5名、学部4年生8名(第3期生)、学部3年生9名(第4期生)が在籍しています。研究業績
【原著論文】
- Kondo S, Nagatake T, Hosomi K, Tojima Y, Ishida K, Saika A, and Kunisawa J. A single bout of high-intensity running exercise transiently and reversibly increases intestinal permeability and neutrophil recruitment in the mouse intestine. Med Sci Sports Exerc. 2026 Feb 1;58(2):208-224. doi: 10.1249/MSS.0000000000003858.
- Iemitsu K, Yoshii K, Hirayama Y, Liu Z, Hifumi S, Kondo S, Ishida K, Nagatake T, and Kunisawa J. 17,18-epoxyeicosatetraenoic acid ameliorates mRNA-LNP-induced local inflammation by inhibiting neutrophil infiltration. J Lipid Res. 2026 Jan;67(1): 100956. doi: 10.1016/j.jlr.2025.100956.
- Morita N, Yamamoto K, Tamano R, Gao P, Nagatake T, Inomata T, Huang T, Yamada Y, Adachi T, Sugai M, Nakayama KI, Kojima H, and Shinkura R. Regulation of selective class-switching provides long term therapeutic benefits for hay fever. JCI Insight. 2025 Oct 21;10(23):e190240. doi: 10.1172/jci.insight.190240.
- Saito Y, Akita M, Saika A, Sano Y, Hotta M, Morimoto J, Uwamizu A, Aoki J, Nagatake T, Kunisawa J, and Sando S. Expedited access to polyunsaturated fatty acids and biofunctional analogues by full solid-phase synthesis. Nat Chem. 2025 Sep;17(9):1391-1400. doi. 10.1038/s41557-025-01853-5.
- Ueda T, Adachi T, Hayashi T, Yasuda K, Matsushita K, Koike E, Yanagisawa R, Nagatake T, Kunisawa J, Ishii KJ, Tsuzuki K, and Kuroda E. Bisphenol A triggers activation of ocular immune system and aggravates allergic airway inflammation. Clin Immunol. 2024 Nov;268:110370. doi. 10.1016/j.clim.2024.1110370.
- Hosomi K, Hatanaka N, Hinenoya A, Adachi J, Tojima Y, Furuta M, Uchiyama K, Morita M, Nagatake T, Saika A, Kawai S, Yoshii K, Kondo S, Yamasaki S, Kunisawa J. QcrC is a potential target for antibody therapy and vaccination to control Campylobacter jejuni infection by suppressing its energy metabolism. Front Microbiol. 2024 Jul 2;15:1415893. doi. 10.3389/fmicb.2024.1415893.
- Saika A, Nagatake T, Kishino S, Kitamura N, Honda T, Hosomi K, Tiwari P, Node E, Kawai S, Kondo S, Ishida K, Kabashima K, Ogawa J, and Kunisawa J. The omega-3 post biotic trans-10-cis-15octadecadienoic acid attenuates contact hypersensitivity in mice through down regulation of vascular endothelial growth factor A. Front Cell Infect Microbiol. 2024 May 22;14:1355679. doi: 10.3389/fcimb.2024.1355679.
- Epub 2022 Nov 11.
- Nagatake T, Kishino S, Urano E, Murakami H, Kitamura N, Konishi K, Ohno H, Tiwari P, Morimoto S, Node E, Adachi J, Abe Y, Isoyama J, Sawane K, Honda T, Inoue A, Uwamizu A, Matsuzaka T, Miyamoto Y, Hirata SI, Saika A, Shibata Y, Hosomi K, Matsunaga A, Shimano H, Arita M, Aoki J, Oka M, Matsutani A, Tomonaga T, Kabashima K, Miyachi M, Yasutomi Y, Ogawa J, and Kunisawa J. Intestinal microbe-dependent ω3 lipid metabolite αKetoA prevents inflammatory diseases in mice and cynomolgus macaques. Mucosal Immunol. 2022 Feb;15(2):289-300. doi: 10.1038/s41385-021-00477-5. Epub 2022 Jan 10.
- Liu Z, Hosomi K, Shimoyama A, Yoshii K, Sun X, Lan H, Wang Y, Yamaura H, Kenneth D, Saika A, Nagatake T, Kiyono H, Fukase K, and Kunisawa J. Chemically synthesized Alcaligenes Lipid A as an adjuvant to augument immune responses to Haemophilus influenza type B conjugate vaccine. Front Pharmacol. 2021 Oct 22;12:763657. doi: 10.3389/fphar.2021.763657.
- Wang Y, Hosomi K, Shimoyama A, Yoshii K, Nagatake T, Fujimoto Y, Kiyono H, Fukase K, and Kunisawa J. Lipopolysaccharide derived from the lymphoid-resident commensal bacteria Alcaligenes faecalis functions as an effective nasal adjuvant to augument IgA antibody and Th17 cell responses. Front Immunol. 2021 Jul 1;12:699349. doi: 10.3389/fimmu.2021.699349.
- Nagatake T, Shibata Y, Morimoto S, Node E, Sawane K, Hirata SI, Adachi J, Abe Y, Isoyama J, Saika A, Hosomi K, Tomonaga T, and Kunisawa J. 12-Hydroxyeicosapentaenoic acid inhibits foam cell formation and ameliorates high-fat diet-induced pathology of atherosclerosis in mice. Sci Rep. 2021 May 17;11(1):10426. doi: 10.1038/s41598-021-89707-1.
- Miyoshi Y, Saika A, Nagatake T, Matsunaga A, Kunisawa J, Katakura Y, and Yamasaki-Yashiki S. Mechanisms underlying enhanced IgA production in Peyer’s patch cells by membrane vesicles derived from Lactobacillus sakei. Biosci Biotechnol Biochem. 2021 May 25;85(6):1536-1545. doi: 10.1093/bbb/zbab065.
- Saika A, Nagatake T, Hirata SI, Sawane K, Adachi J, Abe Y, Isoyama J, Morimoto S, Node E, Tiwari P, Hosomi K, Matsunaga A, Honda T, Tomonaga T, Arita M, Kabashima K, and Kunisawa J. ω3 fatty acid metabolite, 12-hydroxyeicosapentaenoic acid, alleviates contact hypersensitivity by downregulation of CXCL1 and CXCL2 gene expression in keratinocytes via retinoid X receptor a. FASEB J. 2021 Apr;35(4):e21354. Doi: 10.1096/fj.202001687R.
- Hosomi K, Shibata N, Shimoyama A, Uto T, Nagatake T, Tojima Y, Nishino T, Takeyama H, Fukase K, Kiyono H, and Kunisawa J. Lymphoid tissue-resident Alcaligenes establish an intracellular symbiotic environment by creating a unique energy shift in dendritic cells. Front Microbiol. 2020 Sep 24;11:561005. doi: 10.3389/fmicb.2020.561005.
- Nagatake T, Zhao YC, Ito T, Itoh M, Kometani K, Furuse M, Saika A, Node E, Kunisawa J, Minato N, and Hamazaki Y. Selective expression of claudin-5 in thymic endothelial cells regulates the blood-thymus barrier and T-cell export. Int Immunol. 2021 Mar 1;33(3):171-182. doi: 10.1093/intimm/dxaa069.
- Hirata SI, Sawane K, Adachi J, Isoyama J, Sugiura Y, Matsunaga A, Hosomi K, Tomonaga T, Suematsu M, Nagatake T, and Kunisawa J. Vitamin B1 supports the differentiation of T cells through TGF-β superfamily production in thymic epithelial cells. iScience. 2020 Jul 31;23(9):101426. doi: 10.1016/j.isci.2020.101426.
- Yoshii K, Hosomi K, Shimoyama A, Wang Y, Yamaura H, Nagatake T, Suzuki H, Lan H, Kiyono H, Fukase K, and Kunisawa J. Chemically synthesized Alcaligenes lipid A shows a potent and safe nasal vaccine adjuvant activity for the induction of Streptococcus pneumoniae-specific IgA and Th17 mediated protective immunity. Microorganisms. 2020 Jul 23;8(8):E1102. doi: 10.3390/microorganisms8081102.
- Wang Y, Hosomi K, Shimoyama A, Yoshii K, Yamaura H, Nagatake T, Nishino T, Kiyono H, Fukase K, and Kunisawa J. Adjuvant activity of synthetic lipid A of Alcaligenes, a gut-associated lymphoid tissue-resident commensal bacterium, to augment antigen-specific IgG and Th17 responses in systemic vaccine. Vaccines. 2020 Jul 20;8(3):E395. doi: 10.3390/vaccines8030395.
- Lan H, Suzuki H, Nagatake T, Hosomi K, Ikegami K, Setou M, and Kunisawa J. Impaired mucociliary motility enhances antigen-specific nasal IgA immune responses to cholera toxin-based nasal vaccine. Int Immunol. 2020 Jul 28;32(8):559-568. doi: 10.1093/intimm/dxaa029.
- Saika A, Nagatake T, Kishino S, Park S, Honda T, Matsumoto N, Shimojou M, Morimoto S, Tiwari P, Node E, Hirata SI, Hosomi K, Kabashima K, Ogawa J, and Kunisawa J. 17(S),18(R)-epoxyeicosatetraenoic acid generated by cytochrome P450 BM-3 from Bachillus megaterium inhibits the development of contact hypersensitivity via G-protein-coupled receptor 40-mediated neutrophil suppression. FASEB Bioadv. 2019 Dec 24;2(1):59-71. doi: 10.1096/fba.2019-00061. eCollection 2020 Jan.
- Hirata SI, Nagatake T, Sawane K, Hosomi K, Honda T, Ono S, Shibuya N, Saito E, Adachi J, Abe Y, Isoyama J, Suzuki H, Matsunaga A, Tomonaga T, Kiyono H, Kabashima K, Arita M, and Kunisawa J. Maternal w3 docosapentaenoic acid inhibits infant allergic dermatitis through TRAIL-expressing plasmacytoid dendritic cells in mice. Allergy. 2020 Aug;75(8):1939-1955. doi: 10.1111/all.14217. Epub 2020 Mar 4.
- Sawane K, Nagatake T, Hosomi K, Hirata SI, Adachi J, Abe Y, Isoyama J, Suzuki H, Matsunaga A, Fukumitsu S, Aida K, Tomonaga T, Arita M, and Kunisawa J. Dietary omega-3 fatty acid dampens allergic rhinitis via eosinophilic production of the anti-allergic lipid mediator 15-hydroxyeicosapentaenoic acid in mice. Nutrients. 2019 Nov 22;11(12):2868. doi: 10.3390/nu11122868.
- Takahashi I, Hosomi K, Nagatake T, Tobou H, Yamamoto D, Hayashi I, Kurashima Y, Sato S, Shibata N, Goto Y, Maruyama F, Nakagawa I, Kuwae A, Abe A, Kunisawa J, and Kiyono H. Persistent colonization of non-lymphoid tissue-resident macrophages by Stenotrophomonas maltophilia. Int Immunol. 2020 Feb 7;32(2):133-141. doi: 10.1093/intimm/dxz071.
- Li H, NeelankalJohn A, Nagtaake T, Hamazaki Y, and Jiang FX. Claudin 4 in pancreatic b cells is involved in regulating the functional state of adult islets. FEBS Open Bio. 2020 Jan; 10(1):28-40. doi: 10.1002/2211-5463. 12735. Epub 2019 Nov 23.
- Nagatake T, Hirata SI, Koga T, Kuroda E, Kobari S, Suzuki H, Hosomi K, Matsumoto N, Yanrismet Y, Shimojou M, Morimoto S, Sasaki F, Ishii K, Yokomizo T, and Kunisawa J. BLT1 mediates commensal bacteria-dependent innate immune signals to enhance antigen-specific intestinal IgA responses. Mucosal Immunol. 2019 Sep; 12(5):1082-1091. doi: 10.1038/s41385-019-0175-z. Epub 2019 May 29.
- Saika A, Nagatake T, and Kunisawa J. Host- and microbe-dependent dietary lipid metabolism in the control of allergy, inflammation and immunity. Front Nutr. 2019 Apr 10;6:36. doi: 10.3389/fnut.2019.00036. eCollection 2019.
- Tiwari P, Nagatake T, Hirata SI, Sawane K, Saika A, Shibata Y, Morimoto S, Honda T, Adachi J, Abe Y, Isoyama J, Tomonaga T, Kiyono H, Kabashima K, and Kunisawa J. Dietary coconut oil ameliorates skin contact hypersensitivity through mead acid production in mice. Allergy. 2019 Aug;74(8):1522-1532. doi: 10.1111/all.13762. Epub 2019 Apr 10.
- Nagatake T, and Kunisawa J. Emerging roles of metabolites of ω3 and ω6 essential fatty acids in the control of intestinal inflammation. Int Immunol. 2019 Aug 23;31(9):569-577. doi: 10.1093/intimm/dxy086.
- Hosomi K, Hinenoya A, Suzuki H, Nagatake T, Nishino T, Tojima Y, Hirata SI, Matsunaga A, Kondoh M, Yamasaki S, and Kunisawa Development of a bivalent food poisoning vaccine: augmented antigenicity of the C-terminus of Clostridium perfringens enterotoxin by fusion with the B subunit of Escherichia coli Shiga toxin 2. Int Immunol. 2019 Feb 15;31(2):91-100. doi: 10.1093/intimm/dxy071.
- Nagatake T, Suzuki H, Hirata SI, Matsumoto N, Wada Y, Morimoto S, Nasu A, Shimojou M, Kawano M, Ogami K, Tsujimura Y, Kuroda E, Iijima N, Hosomi K, Ishii K, Nosaka T, Yasutomi Y, and Kunisawa J. Immunological association of inducible bronchus-associated lymphoid tissue organogenesis in Ag85B-rHPIV2 vaccine-induced anti-tuberculosis mucosal immune responses in mice. Int Immunol. 2018 Sep 25;30(10):471-481. doi: 10.1093/intimm/dxy046. (Featured articleに選出)
- Sasaki A, Nagatake T (shared first author), Egami R, Gu G, Takigawa I, Ikeba W, Nakatani T, Kunisawa J, and Fujita Y. Obesity suppresses cell-competition-mediated apical elimination of RasV12-transformed cells from epithelial tissues. Cell Rep. 2018 Apr 24;23(4):974-982. doi: 10.1016/j.celrep.2018.03.104.
- Suzuki H, Nagatake T, Nasu A, Lan H, Ikegami K, Setou M, Hamazaki Y, Kiyono H, Yagi K, Kondoh M, and Kunisawa J. Impaired airway mucociliary function reduces antigen-specific IgA response to immunization with a claudin-4-targeting nasal vaccine in mice. Sci Rep. 2018 Feb 13;8(1): 2904. doi: 10.1038/s41598-018-21120-7.
- Nagatake T, Shiogama Y, Inoue A, Kikuta J, Honda T, Tiwari P, Kishi T, Yanagisawa A, Isobe Y, Matsumoto N, Shimojou M, Morimoto S, Suzuki H, Hirata SI, Steneberg P, Edlund H, Aoki J, Arita M, Kiyono H, Yasutomi Y, Ishii M, Kabashima K, and Kunisawa J. The 17,18-epoxyeicosatetraenoic acid-G protein-coupled receptor 40 axis ameliorates contact hypersensitivity by inhibiting neutrophil mobility in mice and cynomolgus macaques. J Allergy Clin Immunol. 2018 Aug;142(2):470-484. e12. doi: 10.1016/j.jaci.2017.09.053. Epub 2017 Dec 27.
- Nakamizo S, Honda T, Adachi A, Nagatake T, Kunisawa J, Kitoh A, Otsuka A, Dainichi T, Nomura T, Ginhoux F, Egawa G, and Kabashima K. High fat diet exacerbates murine psoriatic dermatitis by increasing the number of IL-17-producing γδ T cells. Sci Rep. 2017 Oct 26;7(1):14076. doi: 10.1038/s41598-017-14292-1.
- Hosomi K, Ohno H, Murakami H, Natsume-Kitatani Y, Tanisawa K, Hirata S, Suzuki H, Nagatake T, Nishino T, Mizuguchi K, Miyachi M, and Kunisawa J. Method for preparing DNA from feces in guanidine thiocyanate solution affects 16S rRNA-based profiling of human microbiota diversity. Sci Rep. 2017 Jun 28; 7(1): 4339. doi: 1038/s41598-017-04511-0.
- Kuroda E, Ozasa K, Temizoz B, Ohata K, Koo CX, Kanuma T, Kusakabe T, Kobari S, Horie M, Morimoto Y, Nakajima S, Kabashima K, Ziegler SF, Iwakura Y, Ise W, Kurosaki T, Nagatake T, Kunisawa J, Takemura N, Uematsu S, Hayashi M, Aoshi T, Kobiyama K, Coban C, and Ishii KJ. Inhaled fine particles induce alveolar macrophage death and interleukin-1α release to promote inducible bronchus-associated lymphoid tissue formation. Immunity. 2016 Dec 20;45(6):1299-1310. doi: 10.1016/j.immuni.2016.11.010.
- Kunisawa J, Sugiura Y, Wake T, Nagatake T, Suzuki H, Nagasawa R, Shikata S, Honda K, Hashimoto E, Suzuki Y, Setou M, Suematsu M, and Kiyono H. Mode of bioenergetic metabolism during B cell differentiation in the intestine determines the distinct requirement for vitamin B1. Cell Rep. 2015 Oct 6;13(1):122-31. doi: 10.1016/j.celrep.2015.08.063. Epub 2015 Sep 24.
- Kunisawa J, Arita M, Hayasaka T, Harada T, Iwamoto R, Nagasawa R, Shikata S, Nagatake T, Suzuki H, Hashimoto E, Kurashima Y, Suzuki Y, Arai H, Setou M, and Kiyono H. Dietary ω3 fatty acid exerts anti-allergic effect through the conversion to 17,18-epoxyeicosatetraenoic acid in the gut. Sci Rep. 2015 Jun 11;5:9750. doi: 10.1038/srep09750.
- Nagatake T, Fukuyama S, Sato S, Okura H, Tachibana M, Taniuchi I, Ito K, Shimojou M, Matsumoto N, Suzuki H, Kunisawa J, and Kiyono H. Central role of core binding factor β2 in mucosa-associated lymphoid tissue organogenesis in mouse. PLoS One. 2015 May 22;10(5):e0127460. doi: 10.1371/journal.pone.0127460. eCollection 2015.
- Sanosaka M, Fujimoto M, Ohkawara T, Nagatake T, Itoh Y, Kagawa M, Kumagai A, Fuchino H, Kunisawa J, Naka T, and Takemori H. Salt-inducible kinase 3 deficiency exacerbates lipopolysaccharide-induced endotoxin shock accompanied by increased levels of pro-inflammatory molecules in mice. Immunology. 2015 Jun;145(2):268-78. doi: 10.1111/imm.12445.
- Nagatake T, Fujita H, Minato N, and Hamazaki Y. Enteroendocrine cells are specifically marked by cell surface expression of claudin-4 in mouse small intestine. PLoS One. 2014 Mar 6;9(6):e90638. doi: 10.1371/journal.pone.0090638. eCollection 2014.
- Nagatake T, Kunisawa J. Unique function of mucosa-associated lymphoid tissues as targets of mucosal vaccines. Curr Topics Pharmacol. 2013 Dec:17(1), 13-23.
- Kim DY, Fukuyama S, Nagatake T, Takamura K, Kong IG, Yokota Y, Lee CH, and Kiyono H. Implications of nasopharynx-associated lymphoid tissue (NALT) in the development of allergic responses in an allergic rhinitis mouse model. Allergy. 2012 Apr;67(4):502-9. doi: 10.1111/j.1398-9995.2011.02782.x. Epub 2012 Jan 19.
- Ogawa M, Yoshikawa Y, Kobayashi T, Mimuro H, Fukumatsu M, Kiga K, Piao Z, Ashida H, Yoshida M, Kakuta S, Koyama T, Goto Y, Nagatake T, Nagai S, Kiyono H, Kawalec M, Reichhart JM, and Sasakawa C. A Tecpr1-dependent selective autophagy pathway targets bacterial pathogens. Cell Host Microbe. 2011 May 19;9(5):376-89. doi: 10.1016/j.chom.2011.04.010.
- Kim DY, Sato A, Fukuyama S, Sagara H, Nagatake T, Kong IG, Goda K, Nochi T, Kunisawa J, Sato S, Yokota Y, Lee CH, and Kiyono H. The airway antigen sampling system: respiratory M cells as an alternative gateway for inhaled antigens. J Immunol. 2011 Apr 1;186(7):4253-62. doi: 10.4049/jimmunol.0903794. Epub 2011 Feb 28.
- Nagatake T, Fukuyama S, Kim DY, Goda K, Igarashi O, Sato S, Nochi T, Sagara H, Yokota Y, Jetten AM, Kaisho T, Akira S, Mimuro H, Sasakawa C, Fukui Y, Fujihashi K, Akiyama T, Inoue J, Penninger JM, Kunisawa J, and Kiyono H. Id2-, RORgt-, and LTbR-independent initiation of lymphoid organogenesis in ocular immunity. J Exp Med. 2009 Oct 26;206(11):2351-64. doi: 10.1084/jem.20091436. Epub 2009 Oct 12.
- Takamura K, Fukuyama S, Nagatake T, Kim DY, Kawamura A, Kawauchi H, and Kiyono H. Regulatory role of lymphoid chemokine CCL19 and CCL21 in the control of allergic rhinitis. J Immunol. 2007 Nov 1;179(9):5897-906.
- Tanaka N, Fukuyama S, Fukuiwa T, Kawabata M, Sagara Y, Ito HO, Miwa Y, Nagatake T, Kiyono H, and Kurono Y. Intranasal immunization with phosphorylcholine induces antigen specific mucosal and systemic immune responses in mice. Vaccine. 2007 Mar 30;25(14):2680-7. Epub 2006 Nov 10.
- Fukuyama S, Nagatake T, Kim DY, Takamura K, Park EJ, Kaisho T, Tanaka N, Kurono Y, and Kiyono H. Cutting edge: Uniqueness of lymphoid chemokine requirement for the initiation and maturation of nasopharynx-associated lymphoid tissue organogenesis. J Immunol. 2006 Oct 1;177(7):4276-80.
【著書・総説】
- 長竹貴広. 食の免疫制御を担う実効成分と作用機構の解明に向けて「腸内細菌学雑誌」(腸内細菌学会誌)2026年1月 40巻1号 33-36.
- 渡邉あやの, 馬場翔平, 長竹貴広. 免疫制御における必須脂肪酸代謝物の機能解明と腸内細菌の関与「腸内細菌代謝産物の生体調節機能」(シーエムシー出版)2025年11月 28日, 93-100(全279ページ).
- 長竹貴広. 必須脂肪酸の代謝と免疫制御, 個人差「実験医学増刊号: 健康社会を実現する精密栄養学」(羊土社)2023年6月 41巻10号 117-122.
- 長竹貴広, 國澤純. B細胞やT細胞の分化制御におけるビタミンB1の役割「臨床免疫・アレルギー科」(科学評論社)2023年6月 79巻6号 658-662.
- 長竹貴広, 國澤純. 免疫バランス制御におけるオメガ3脂肪酸代謝物の働きとメカニズム解明「食品と開発」(インフォーママーケッツジャパン)2022年2月 57巻2号 18-20.
- 石田渓, 長竹貴広, 國澤純. 腸内環境を介した免疫制御とアレルギー・炎症との関わり「リンパ学」(日本リンパ学会)2021年12月 44巻2号 77-81.
- 長竹貴広, 國澤純. 皮膚に及ぼす食の免疫学的影響の理解と応用「日本香粧品学会誌」2021年12月 45巻4号 348-352.
- 長竹貴広. 免疫制御における必須脂肪酸代謝物の機能解明と腸内細菌の関与「腸内細菌学雑誌」(腸内細菌学会誌)2021年10月 35巻4号 223-229.
- 長竹貴広, 國澤純. 加齢による免疫フレイル・炎症・脂質代謝「フレイル予防と予防医学(監修:矢澤一良)」(シーエムシー出版)2021年6月23日, 45-55(全214ページ).
- 石田渓, 長竹貴広, 國澤純. ω3脂肪酸代謝物に見出された新たな抗炎症・抗アレルギー作用「オメガ3脂肪酸の技術と市場(監修:小川順)」(シーエムシー出版)2021年4月28日, 52-60(全200ページ).
- 長竹貴広, 國澤純. 加齢による免疫フレイル・炎症・脂質代謝「BIO INDUSTRY:抗フレイルと予防医学」(シーエムシー出版) 2021年1月 38巻1号 41-51.
- 長竹貴広, 國澤純. アレルギー性皮膚炎を改善するω3脂肪酸代謝物の作用機構「フレグランスジャーナル:肌が持つ力を考究する」(フレグランスジャーナル社)2020年11月 48巻11号 45-50.
- 長竹貴広, 國澤純. オメガ3, オメガ6必須脂肪酸代謝物による免疫制御「生物工学会誌: 脂質がつなぐもの:生物工学的脂質研究が導く新しい学際研究と産業(後編)」(日本生物工学会誌)2020年10月 98巻10号 544-548.
- 石田渓, 長竹貴広, 國澤純. ω3脂肪酸代謝物に見出された新たな抗炎症・抗アレルギー作用「BIO INDUSTRY:ω-3脂肪酸」(シーエムシー出版) 2020年10月 37巻10号 53-62.
- 長竹貴広, 國澤純. 免疫・アレルギー・炎症を制御する必須脂肪酸代謝物の新機能「脂質・脂肪酸関連物質の使いこなし方-素材開発・機能創生・応用技術-(監修:石井淑夫)」(テクノシステム)2020年9月4日, 239-246(全592ページ).
- 長竹貴広, 國澤純. 必須脂肪酸代謝物による免疫制御の実態解明「FOOD STYLE 21: 腸内環境の改善から全身の健康へ/オーラルケア最新情報」(食品化学新聞社)2020年3月 24巻3号 31-34.
- 長竹貴広, 國澤純. ω3, ω6, ω9脂肪酸の代謝による新たな免疫・アレルギー・炎症の制御機構「化学と生物」(日本農芸化学会会誌)2020年3月 58巻2号 97-104.
- 長竹貴広, 國澤純. プロバイオティクス、プレバイオティクス、シンバイオティクスとは「糖尿病ケア:スルスルわかる糖尿病と腸内細菌の関係」(メディカ出版)2020年1月 17巻1号 16-18.
- 長竹貴広, 國澤純. 食用油の脂肪酸組成のユニーク性を利用した多臓器アレルギー・炎症疾患の制御「実験医学増刊号: 新時代が始まったアレルギー疾患研究」(羊土社)2019年6月 37巻10号 113-120.
- 長竹貴広, 國澤純. 食用油を起点に形成される脂質代謝ネットワークと免疫制御「実験医学: 食の機能実効分子」(羊土社)2019年3月 37巻4号 502-507.
- 長竹貴広, 國澤純. 健康状態を左右する腸内環境因子としての食事と腸内細菌叢「Cardiac Practice: 腸内細菌と循環器疾患」(メディカルレビュー社)2019年2月 29巻4号45-49.
- Nagatake T, Kunisawa J, and Kiyono H. Lymphoid tissues associated with gastrointestinal (GI) mucosa. 「Lymph Node Metastasis in Gastrointestinal Cancer, (Editor: Natsugoe S)」(Springer Singapore) 2019 Feb, 111-126 (Total 358 page), DOI: 1007/978-981-10-4699-5.
- 長竹貴広, 國澤純. マウスとカニクイザルにおいて17,18-EpETEは好中球のGPR40を介した遊走抑制によって接触皮膚炎を改善する「臨床免疫・アレルギー科: アレルギー性皮膚疾患の病態解明」(科学評論社)2018年8月 70巻2号145-149.
- 長竹貴広, 國澤純. 脂肪酸代謝物による腸管・皮膚アレルギーの制御「細胞: 脂質メディエーターと病態」(ニューサイエンス社)2018年3月 50巻3号 13-17.
- 長竹貴広, 國澤純. 免疫・ワクチン応答を左右する腸内環境因子としての栄養と腸内細菌「医学のあゆみ: 近未来のワクチン—開発研究の潮流と課題」(医歯薬出版)2018年2月 264巻5号 403-410.
- 長竹貴広, 國澤純. 食物アレルギーの発症における食用油クオリティの影響「化学と生物」(日本農芸化学会会誌)2017年1月 55巻1号 11-12.
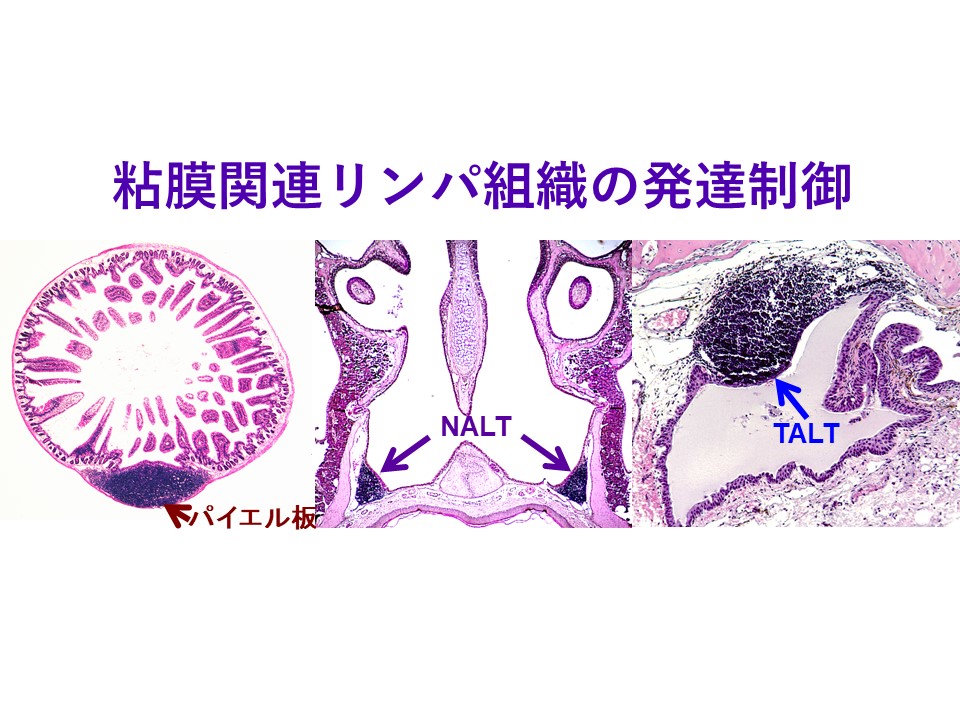
- 中橋理佳, 長竹貴広, 清野宏. 粘膜関連リンパ組織のユニーク性と臨床応用「リンパ学」(日本リンパ学会機関誌リンパ学)2016年12月 39巻第2号 80-87.
- 長竹貴広, 國澤純. 脂質を介した腸管免疫の制御と疾患 「実験医学増刊号: 脂質疾患学」(羊土社) 2015年9月 33巻15号 94-99.
- 長竹貴広, 國澤純. 腸管組織における多元的免疫制御システムと食物アレルギー 「医学のあゆみ: 粘膜免疫Update」(医歯薬出版)2015年5月 253巻5号 451-456.
- 長竹貴広, 國澤純. 脂質を介した腸管免疫システムの制御 「医学のあゆみ: 生命を支える脂質」(医歯薬出版)2014年3月 248巻13号 1019-1024.
- 長竹貴広, 清野宏. 粘膜関連リンパ組織「免疫の事典(編集:桂義元, 河本宏, 小安重夫, 山本一彦)」(朝倉書店)2011年12月 325-326(全488ページ).
- 高橋一郎, 長竹貴広, 清野宏. 基礎の基礎「細胞工学: 粘膜免疫システム」(秀潤社)2011年3月 30巻4号 342-347.
- 福山聡, 長竹貴広, 清野宏. 粘膜関連リンパ組織の特徴と組織構築分子基盤-鼻咽頭関連リンパ組織(NALT)- 「臨床粘膜免疫学(編集:清野宏)」(シナジー社)2010年12月20日 164-170(全722ページ).
- 佐藤慎太郎, 長竹貴広, 清野宏. 粘膜関連リンパ組織の特徴と組織構築分子基盤-涙道関連リンパ組織(TALT)- 「臨床粘膜免疫学(編集:清野宏)」(シナジー社)2010年12月20日 171-175(全722ページ).
- Fukuyama S, Nagatake T, Kiyono H. Mucosa-associated lymphoid tissue and dynamics of lymphoid cells in the five different compartments in allergic diseases. 「Allergy Frontiers: Classification and Pathomechanisms (Editors: Pawankar R, Holgate ST, Rosenwasser LJ)」(Springer) 2009 Apr; 2: 563-601(全603ページ).
- 福山聡, 長竹貴広, 清野宏. 呼吸器関連リンパ組織の組織形成と免疫学的機能「実験医学増刊号: 粘膜免疫からの感染と免疫応答機構」(羊土社)2007年11月 25巻20号 66-72.
- 長竹貴広, 福山聡, 清野宏. マウスにおけるNALT単核球分離法 「日本免疫学会 Newsletter」(日本免疫学会)2006年12月 14巻2号
- 長竹貴広, 福山聡, 清野宏. 粘膜免疫機構とケモカイン「アレルギー・免疫: ケモカインとアレルギー」(医薬ジャーナル社)2006年1月 13巻1号 38-44.
- 長竹貴広, 福山聡, 清野宏. NALTの形成とケモカイン 「臨床免疫: リンパ球、リンパ組織の分化と関与分子」(科学評論社)2005年1月 43巻1号 12-17.
- 長竹貴広, 福山聡, 清野宏. 粘膜免疫と免疫寛容 「アレルギー科: 粘膜免疫とアレルギー」(科学評論社)2004年12月 18巻6号 467-475.