教員個人(研究室)ページ
生体機能物質学研究室

<研究略歴>
1993年東京大学大学院農学系研究科農芸化学専攻博士課程修了。東京大学農学部助手、明治大学農学部講師、准教授を経て現職。
<主な担当科目>
生体機能物質学、生物有機化学、生命科学実験研究テーマ
1.糖尿病合併症発症メカニズムに関する研究
糖尿病は血糖値が慢性的に高くなっている状態ですが、この状態が長く続くと、網膜症、神経障害、腎症、動脈硬化症などの「糖尿病合併症」の発症につながります。これら合併症によって失明、下肢切断や人工透析導入など「生活の質(QOL)」が低下するだけでなく、死亡率も高くなることから、合併症の予防・治療は重要な課題となっています。この課題の解決のためには発症原因の解明が不可欠ですが、近年の研究によって「メイラード反応」が発症に深く関わることが明らかとなってきました。
「メイラード反応」は糖などのカルボニル基とタンパク質などのアミノ基との間におきる反応です。メイラード反応はもともと食品の加工・貯蔵中の反応として発見され、農学・食品学の分野の研究対象となってきましたが、この反応がわれわれの体内でも進行すること、とくに血糖値の高い糖尿病の患者さんでは反応が進みやすいことがわかっています。
体内でメイラード反応が進行すると、タンパク質のリシンやアルギニン残基に「複雑で多様な修飾構造(AGE)」が形成されます。一方、さまざまな細胞の表面にはAGEを結合して細胞内に信号を伝えるタンパク質(受容体)が存在します。RAGEと呼ばれるこの受容体が、多様なAGEのうちの特定の構造と結合すると、細胞機能障害がひきおこされ、合併症発症につながると考えられています。しかしながら「多様なAGEのうち、どのような構造が発症に関わるのか」「RAGEの本来の機能は何か」などの問題については、未解明の点が残されています。当研究室では、糖尿病合併症発症メカニズムの解明に貢献することを目標として、以下の研究を行っています。
(1)AGEの生理作用と化学構造の関連性の解析: 体内で形成されるAGEの構造は多種多様ですが、「どの構造が合併症の原因となるのか」「どの構造がRAGEに結合し易いのか」などの疑問は完全には解決されていません。当研究室では毒性が強いAGEの化学構造の解明に取り組んでいます。この過程で当研究室では「RAGEに結合して毒性を発揮するAGE構造」の一部を明らかにしました。具体的には「グリセルアルデヒド」という糖から形成されるAGEやその類縁化合物をいくつか合成し、その細胞毒性、ヒトRAGE組換えタンパク質との結合活性を解析しました。その結果、「3-ヒドロキシピリジニウム(3HP)」という化学構造が、毒性やRAGEとの結合性に重要であることが明らかとなりました。重要な構造は3HP以外にも存在する可能性はありますが、グリセルアルデヒドから形成されるAGEの強い生理活性は、3HP構造に起因すると考えられます。
(2)受容体RAGEの機能に関する研究 :RAGEがAGEと結合することによって合併症が発症することを考えると「RAGEなど百害あって一利なし」とも思えますが、RAGEにも生体にとって有利に働く本来の働き・機能があるはずです。その1つが細胞膜の損傷感知であることが知られていますが、当研究室ではこれまでに知られていなかった「RAGEの新たな機能」の解明に取り組んでいます。これに関連し、当研究室では「RAGEの新たなリガンド(受容体に結合して作用を発揮する分子)」を見出しました。
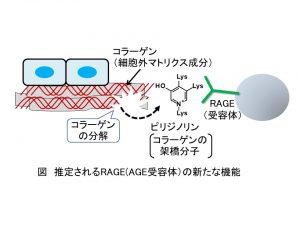
糖尿病状態では上の(1)で明らかとなった「3HP構造をもつAGE」が体内に形成され、RAGEに結合して合併症をひきおこします。一方で健常者の体内ではAGEが形成されにくいので、「RAGEにはAGEとは別の、内在性の(もともと体内に存在する)リガンドが存在するのではないか」と考えました。解析の結果、コラーゲンに特有に存在する「架橋(タンパク質線維を結びつける橋渡し構造)」である「ピリジノリン」がRAGEに結合して細胞に作用することを見出しました。
コラーゲンは細胞の「土台」となる「細胞外マトリクス」の主要成分です。ピリジノリンはコラーゲン線維を束ねる形で存在していますが、コラーゲンが分解・損傷を受けると線維から遊離して(外れて)きます。当研究室の研究成果は、RAGEの本来の機能の1つが「コラーゲンの分解の感知」である可能性を示唆していると考えられます(下図は、推定されるRAGEの新たな機能を示したもの)。
現在はこの機能の生理学的な意義について明らかにするために、さまざまな細胞種における遺伝子発現変化の解析などを進めていますが、この機能をくわしく解明できれば、糖尿病合併症の発症メカニズムの理解にも大きく貢献できると考えています。
(3)新たなAGEの探索と構造解析:3HP構造をもつAGEは、受容体RAGEに結合して生理作用や細胞毒性を発揮することが明らかとなりましたが、このようなAGEには未解明のものが多く存在すると考えられます。実際に当研究室では、ある種の代謝異常で増大する化合物から生じる新奇なAGEを見出し、その化学構造を明らかにするとともにRAGEとの結合性などを実証しました。今後は、検出・定量法(血液や組織のタンパク質にどのくらいこの構造が形成されるのかしらべる方法)を確立し、疾患動物モデルを用いて病態との関連性を検証する計画です。
(4)AGEの形成を抑制する食品成分に関する研究 :体内でのAGEの形成を抑制できれば、合併症の発症や進行を抑えられると考えられます。当研究室では、上述した「毒性の強いAGE構造」の形成を抑制する新たな食品成分を見出しつつあります。
2.腸管上皮細胞が分泌する抗菌因子に関する研究
腸管には数多くの共生細菌が常に存在しますが、その種類と割合はわれわれの健康に重要な役割を果たしています。すなわち健康に有益な菌の数や割合が減って、有害な菌の数や割合が増えると、炎症性疾患・アレルギーなどの発症につながることが知られています。また、腸管にはときには食中毒菌なども入ってくることがあり、感染症のリスクとなります。
このことから腸管において有益な菌を増やし、食中毒菌をはじめ有害な菌を減らすことが健康維持に重要であり、そのために抗菌因子が大きな役割を果たしています。当研究室では、腸管の壁を形成する「腸管上皮細胞」が分泌する抗菌性レクチンの解析を行っています。これまでにその抗菌特性や糖結合性などを明らかにしてきました。とくに最近、この抗菌性レクチンが特定の乳酸菌には抗菌作用を発揮しないこと、すなわちその乳酸菌の割合を相対的に増やすはたらきをもつ可能性を見出しています。
研究室メンバー
博士3年 1名; 修士2年 1名; 修士1年 3名; 学部4年 6名; 学部3年 6名研究業績
<学術論文>
S. Fujimoto, Y. Murakami, H. Miyake, F. Hayase, and H. Watanabe, Identification of a novel advanced glycation end product derived from lactaldehyde. Biosci. Biotechnol. Biochem. 83: 1136-1145. 2019.
Y. Murakami, T. Fujino, R. Kurachi, T. Hasegawa, T. Usui, F. Hayase, and H. Watanabe, Identification of pyridinoline, a collagen crosslink, as a novel intrinsic ligand for the receptor for advanced glycation end-products (RAGE). Biosci. Biotechnol. Biochem. 82: 1508-1514. 2018.
Y. Murakami, T. Fujino, T. Hasegawa, R. Kurachi, A.Miura, T. Daikoh, T. Usui, F. Hayase, and H. Watanabe, Receptor for advanced glycation end-products (RAGE)-mediated cytotoxicity of 3-hydroxypyridinium derivatives. Biosci. Biotechnol. Biochem. 82: 312-319. 2018.
<著書・総説>
渡辺寛人、早瀬文孝「AGEsの化学構造」、AGEsと老化、p55-61メディカルレビュー社 (2013)